Physiopathologie de l’eczéma atopique
La dermatite atopique (DA) ou l’eczéma atopique n’est pas une maladie homogène, elle regroupe plusieurs phénotypes avec probablement plusieurs mécanismes physiopathologiques différents :
-
- la DA mineure résolutive dans l’enfance (phénotype le plus fréquemment observé) ;
-
- la DA sévère, précoce et chronique, avec des morbidités atopiques associées : asthme, rhinite allergique, allergies alimentaires ;
-
- la DA débutant tardivement à l’adolescence ou à l’âge adulte ;
-
- les formes atypiques de type prurigo-like.
La marche atopique
Le dérèglement du système immunitaire (inné et adaptatif) et l’altération de la barrière cutanée congénitale sont deux altérations fondamentales à l’origine de l’inflammation cutanée. Ils sont influencés par des facteurs génétiques et environnementaux.
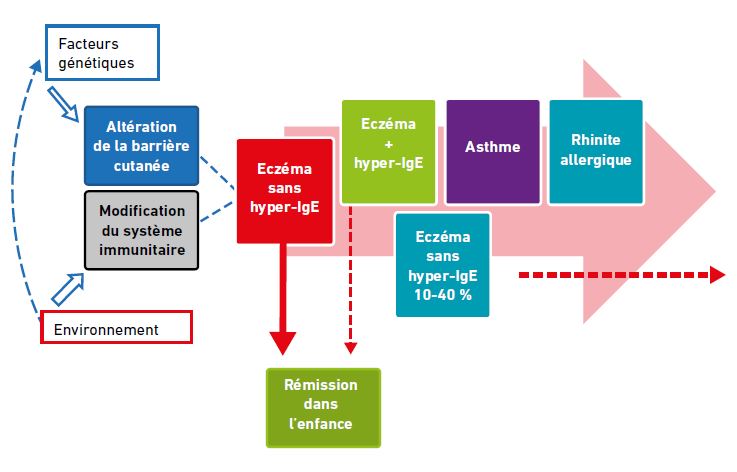
La majorité des patients atteints de DA précoce ne développent pas de sensibilisation IgE et entrent en rémission dans l’enfance : les lésions disparaissent et ne récidivent pas. Dans certains cas, la DA évoluera vers un mécanisme appelé la marche atopique [1] qui associe des sensibilisations par voie transcutanée avec hyper-IgE et parfois des allergies ; ces patients développent très souvent d’autres manifestations atopiques (asthme, allergie alimentaire, rhinite allergique). Enfin, dans 10 à 40 % des cas, un eczéma sans hyper-IgE va apparaître dès l’enfance ou à l’âge adulte et perdurer tout au long de la vie (fig. 1).
Fig 1 : Evolution de la DA
Génétique et DA
Les facteurs génétiques sont importants dans la physiopathologie de cette maladie. En effet, la concordance chez les jumeaux monozygotes présentant une DA est de 77 %. La DA est une maladie polygénique et l’étude du génome humain entier a permis de découvrir 31 loci surexprimés chez les patients atteints de DA, appartenant à 2 groupes de gènes : des gènes impliqués dans la physiopathologie des barrières épithéliales (dont le gène de la filaggrine) et des gènes impliqués dans la réponse immunitaire (notamment dans l’immunité adaptative de type TH2 qui produit des interleukines IL4, IL5 et IL13).
Filaggrine et DA
La filaggrine est une protéine qui retient l’eau dans la peau et permet donc à celle-ci d’être hydratée. Environ 10 % de la population générale (Europe et Asie) est atteinte de mutation hétérozygote de la filaggrine et cette mutation multiplie le risque de développer une DA par 3 à 4 [2]. Cependant, seuls 30 % des patients atteints de DA présentent une mutation hétérozygote de la filaggrine, ce qui ne peut donc suffire à expliquer la physiopathologie des anomalies de la barrière cutanée dans la DA. D’autres modèles d’altérations génétiques de la barrière cutanée, du type mutations des claudines (protéines intervenant dans les jonctions serrées), ont pu être retrouvées, en particulier en Afrique.
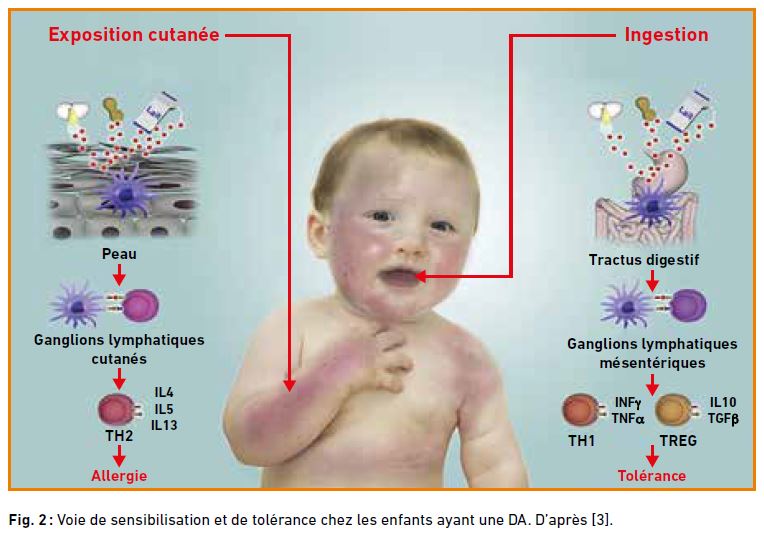
Fig. 2 : Voie de sensibilisation et de tolérance chez les enfants ayant une DA. D’après [3].
DA et sensibilisation
La sensibilisation des enfants présentant une DA se fait habituellement par voie cutanée, avec activation de la voie Th2 qui conduit à une allergie. À l’inverse, l’exposition précoce aux allergènes par voie orale des enfants atteints de DA induit une tolérance via l’activation de la voie Th1 et des T régulateurs (fig. 2).
Ainsi, par exemple, la diversification alimentaire chez les enfants atteints de DA doit se faire précocement selon les recommandations habituelles, comme pour tous les autres enfants, car elle induit une tolérance immunitaire [3].
Anomalie de la barrière cutanée et inflammation
L’inflammation cutanée (via la voie Th2) induit l’augmentation de la production de cytokines (IL4, IL13, IL31, IL33) qui va être responsable d’une diminution d’expression de la filaggrine dans la peau [4] et par là-même d’une majoration de la xérose cutanée, d’une augmentation du pH de la peau, d’une augmentation de l’activité des protéases et d’une augmentation du portage de staphylocoque Aureus cutané. L’inflammation cutanée est donc associée à une dysbiose (déséquilibre du microbiote cutané). Ainsi, la diminution de la filaggrine aboutira à une inflammation cutanée qui, elle-même, fera diminuer l’expression de la filaggrine, aboutissant à un véritable cercle vicieux. L’application d’un anti-inflammatoire sur la peau pourra donc induire une augmentation de l’expression de la filggrine et permettre ainsi de diminuer l’inflammation.
Quels sont les acteurs de la physiopathologie de la DA ?
Les facteurs intervenant dans la physiopathologie de la DA sont multiples :
- barrière cutanée défectueuse : mutation du gène codant pour la protéine de la filaggrine dans 30 % des cas ainsi que d’autres anomalies (jonctions serrées, protéines épidermiques) ;
- terrain génétique ;
- anomalies de la réponse immune innée (anomalie de la réponse aux récepteurs TLR, anomalies des peptides anti-microbiens dans la peau) ;
- anomalies de la réponse immune adaptative de type TH1/Th17 (dans les réactions chroniques) et Th2/Th22 (dans les réactions aiguës) ;
- auto-immunité (principalement auto-IgE dans les formes de DA chroniques de l’adulte) ;
- dysbiose du microbiote cutané : il s’agit d’un déséquilibre du microbiote correspondant à une diminution de la diversité du microbiote favorisant la prolifération du staphylocoque doré aux dépens des autres bactéries commensales cutanées ;
- dysbiose du microbiote digestif ;
- le grattage chronique induit la libération d’une cytokine clé, la TSLP, issue des kératinocytes ; cette cytokine induit une cascade inflammatoire ;
- l’environnement avec les allergènes et les endotoxines bactériennes agit sur l’ensemble des précédents facteurs impliqués dans la DA.
Différents endophénotypes dans la DA
Il existerait plusieurs endophénotypes dans la DA, associés à des mécanismes physiopathologiques différents :
- dans l’endophénotype Th2, l’inflammation de type Th2 est prédominante, le traitement repose principalement sur l’amélioration de la barrière cutanée (grâce aux émollients), le traitement de l’inflammation précoce (avec des dermocorticoïdes ou le tacrolimus topique) et, pour certains patients, par les bio-médicaments anticytokines Th2 comme le dupilumab ;
- l’endophénotype Th1 correspondrait aux DA sévères chroniques de l’adulte et nécessiterait théoriquement des immunosuppresseurs classiques (ciclosporine, méthotrexate).
Bibliographie
- Dharmage SC, Lowe AJ, Matheson MC et al. Atopic dermatitis and the atopic march revisited. Allergy, 2014; 69:17-27.
- Schuttelaar MLA, Kerkhof M, Jonkman MF
et al. Filaggrin mutations in the onset of eczema, sensitization, asthma, hay fever and the interaction with cat exposure. Allergy, 2009;64:1758-1765. - Perkin MR, Lack G. Introducing Allergenic Foods in Infants. N Engl J Med, 2016;375:e16.
- Czarnowicki T, Krueger JG, Guttman-Yassky E. Skin barrier and immune dysregulation in atopic dermatitis: an evolving story with important clinical implications. J Allergy Clin Immunol Pract, 2014;2:371-379.
Rédigé par les Drs Emilie Brénaut et Justine Daguzé, d’après la communication du Dr Sébastien Barbarot (service de Dermatologie, école de l’Atopie, CHU, NANTES et Président ResoEczéma).
MAJ : 26 octobre 2018