Une histoire familiale dans près d’un tiers des cas
Environ 1 patient sur 3 présente une forme familiale de MV, avec un mode de transmission autosomique dominant. Les premières études de liaison réalisées dans des familles multiplexes, c’est-à-dire comprenant des membres atteints dans plusieurs générations, ont permis de repérer des loci sur trois chromosomes : le 1 (1p21.1-1q25.3), le 6 (6q25.1-6q25.2) et le 19 (19p12-q13.11), qui contiennent vraisemblablement un gène responsable de la maladie.
Une deuxième phase de recherche dans des familles chinoises multiplexes a permis d’identifier des mutations hétérozygotes de 3 gènes de la â-sécrétase [1]. Ce complément enzymatique, dont l’une des cibles est la protéine NOTCH, acteur important de l’homéostasie du follicule pilo-sébacé et des cellules épithéliales, se constitue de quatre sous-unités :
– une protéine catalytique, codée par les gènes presenilin 1 et 2 (PSEN1 et PSEN2) ;
– et trois cofacteurs, codés par les gènes presenilin enhancer (PSENEN), nicastrin (NCSTN) et anterior pharynx defective homolog (APH1A et APH1B).
Dans les familles étudiées, des mutations correspondant à des pertes de fonction ont été notées dans les gènes NCSTN (qui s’avère localisé dans le locus de liaison sur le chromosome 1), PSEN1 et PSENEN.
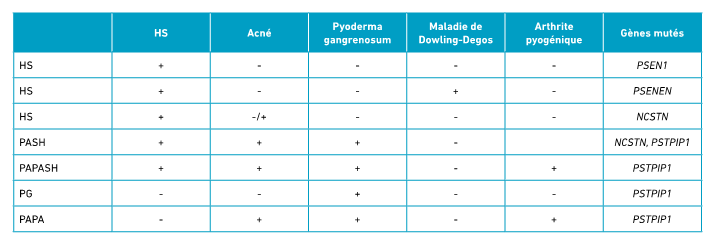
Tableau II : Génétique de l’hidrosadénite suppurée (HS) et de ses formes syndromiques.
Des mutations des gènes de la â-sécrétase à travers le monde
Des mutations des gènes NCSTN et PSENEN ont ensuite été rapportées dans des cas familiaux ou sporadiques à travers le monde. Des mutations de NSCTN ont été trouvées chez des patients ayant en commun une MV sévère et étendue, résistant au traitement standard et souvent associée à une acné conglobata. Des mutations de PSENEN ont été notées, d’une part, chez des patients atteints de MV qui présentaient aussi le plus souvent une maladie de Dowling-Degos, et d’autre part, chez des sujets ayant également un syndrome des comédons familiaux.
Chez les patients atteints de formes syndromiques, ce sont des mutations des gènes NCSTN et PSTPIP1 (proline-serine-threonine phosphatase interacting protein 1) qui ont été identifiées (tableau II).
Le décryptage en cours dans une cohorte européenne
Les équipes de l’Institut Imagine et du Centre médical de l’Institut Pasteur ont constitué une cohorte de 171 patients atteints de MV pour approfondir l’exploration génétique. Après une première phase de séquençage des gènes de la â-sécrétase par la méthode de Sanger, un panel de séquençage haut-débit (Next Generation Sequencing, NGS) a été mis au point pour cibler 50 gènes, comprenant les 6 de la â-sécrétase et des candidats impliqués dans d’autres maladies inflammatoires.
Cette approche a permis de découvrir quelques nouvelles mutations de NCSTN, PSEN1 et PSENEN, mais aucune mutation causale dans ces gènes n’a été retrouvée pour 96 % de la cohorte. Afin d’identifier de nouveaux gènes de la MV, un séquençage d’exome a été réalisé dans 6 familles informatives et 5 cas sporadiques et leurs parents. Des variants candidats ont ainsi été isolés, mais des études complémentaires sont nécessaires pour valider leur implication dans la MV.
Les difficultés rencontrées pour identifier de nouveaux gènes pourraient avoir plusieurs causes : l’hétérogénéité clinique, l’intervention de facteurs confondants environnementaux ou une génétique plus complexe (pénétrance incomplète, gènes modificateurs, formes oligogéniques, formes multifactorielles…).
Pour progresser, la stratégie consiste à étudier tous les patients non apparentés avec le panel NGS ciblé, puis à sélectionner les cas les plus informatifs chez lesquels aucune mutation n’est identifiée et réaliser un séquençage d’exome.
L’aide des cliniciens est capitale pour identifier les phénotypes cliniques pouvant correspondre à des sous-groupes génétiquement plus homogènes, notamment dans les situations suivantes :
– survenue précoce de la maladie et phénotype clinique sévère ;
– membres de familles avec des cas dans plusieurs générations (sans comorbidités) ;
– phénotypes particuliers tels que syndrome PASH et MV associée à une maladie de Dowling-Degos ou une acné sévère.
Bibliographie
Wang B et al. Science, 2010;330:1065.
D’après la communication du Dr Sabine Duchatelet (généticienne, Institut Imagine, Paris).
Auteur : Dr Pascale Boghen, dermatologue