L’eczéma chronique des mains
L’eczéma chronique des mains (ECM) est une maladie multifactorielle très fréquente dans la population générale. Si les traitements topiques existants permettent de soigner l’eczéma léger, les traitements disponibles pour un contrôle efficace à long terme des formes modérées à sévères sont insatisfaisants mais progressent rapidement.
Épidémiologie et Étiologies
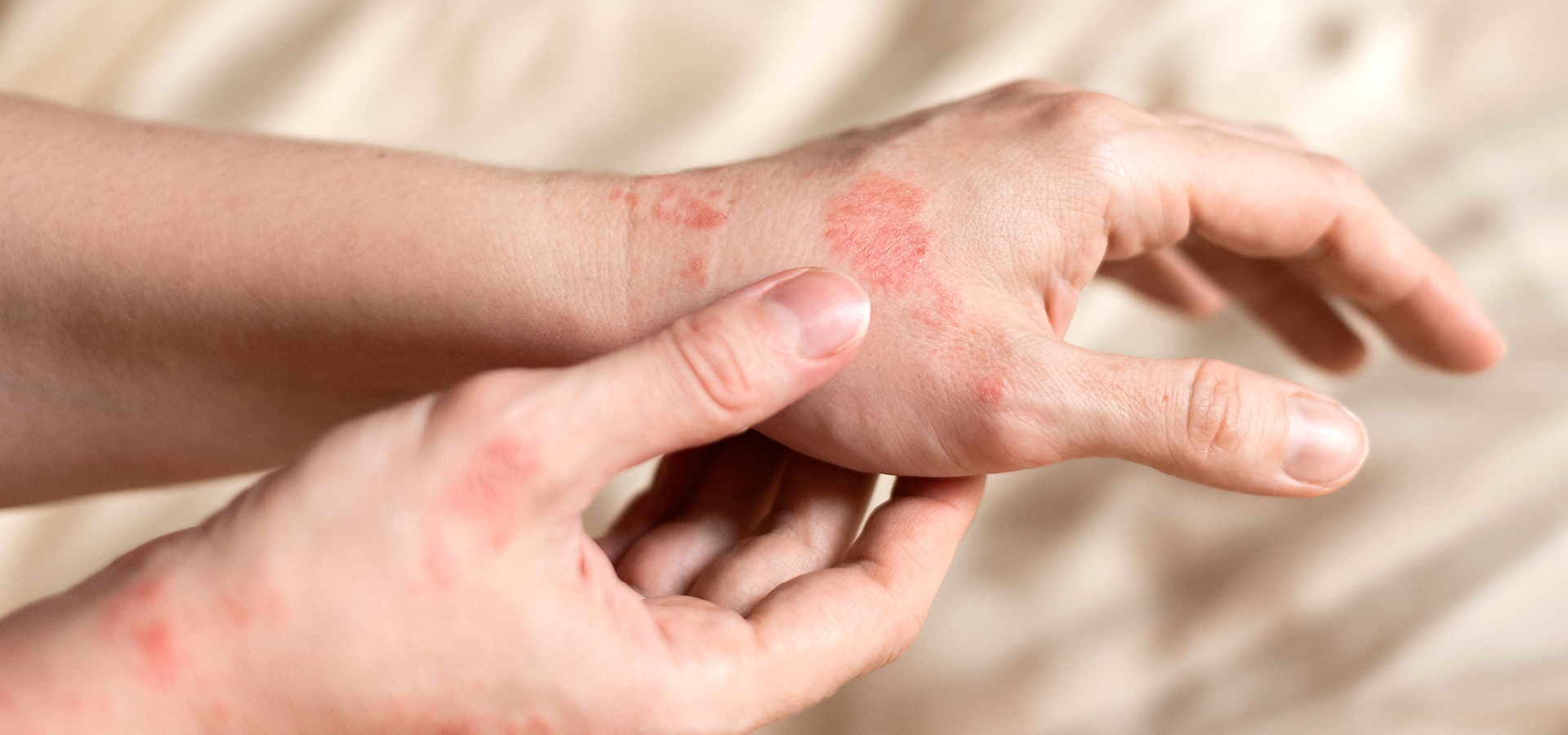
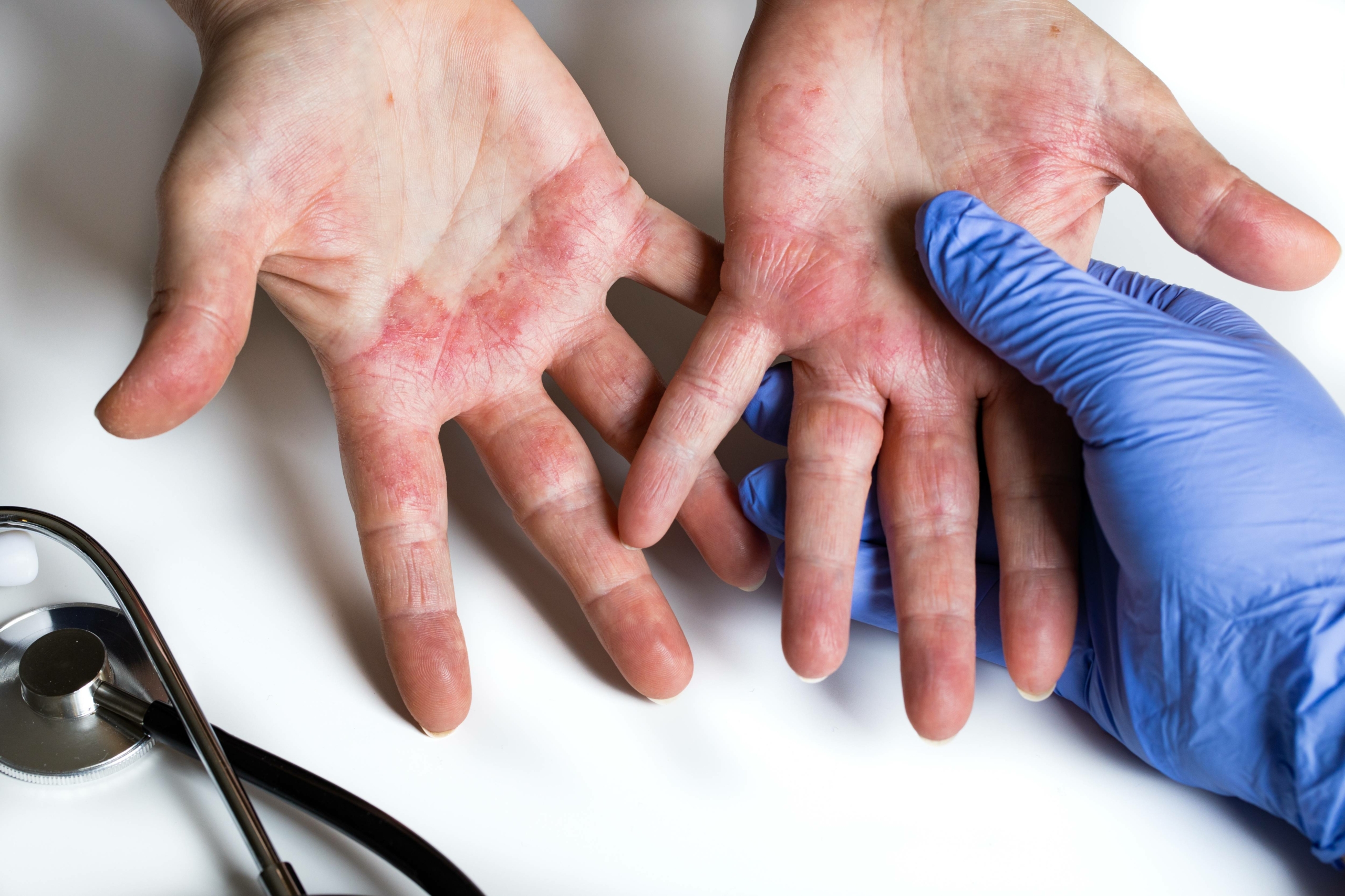
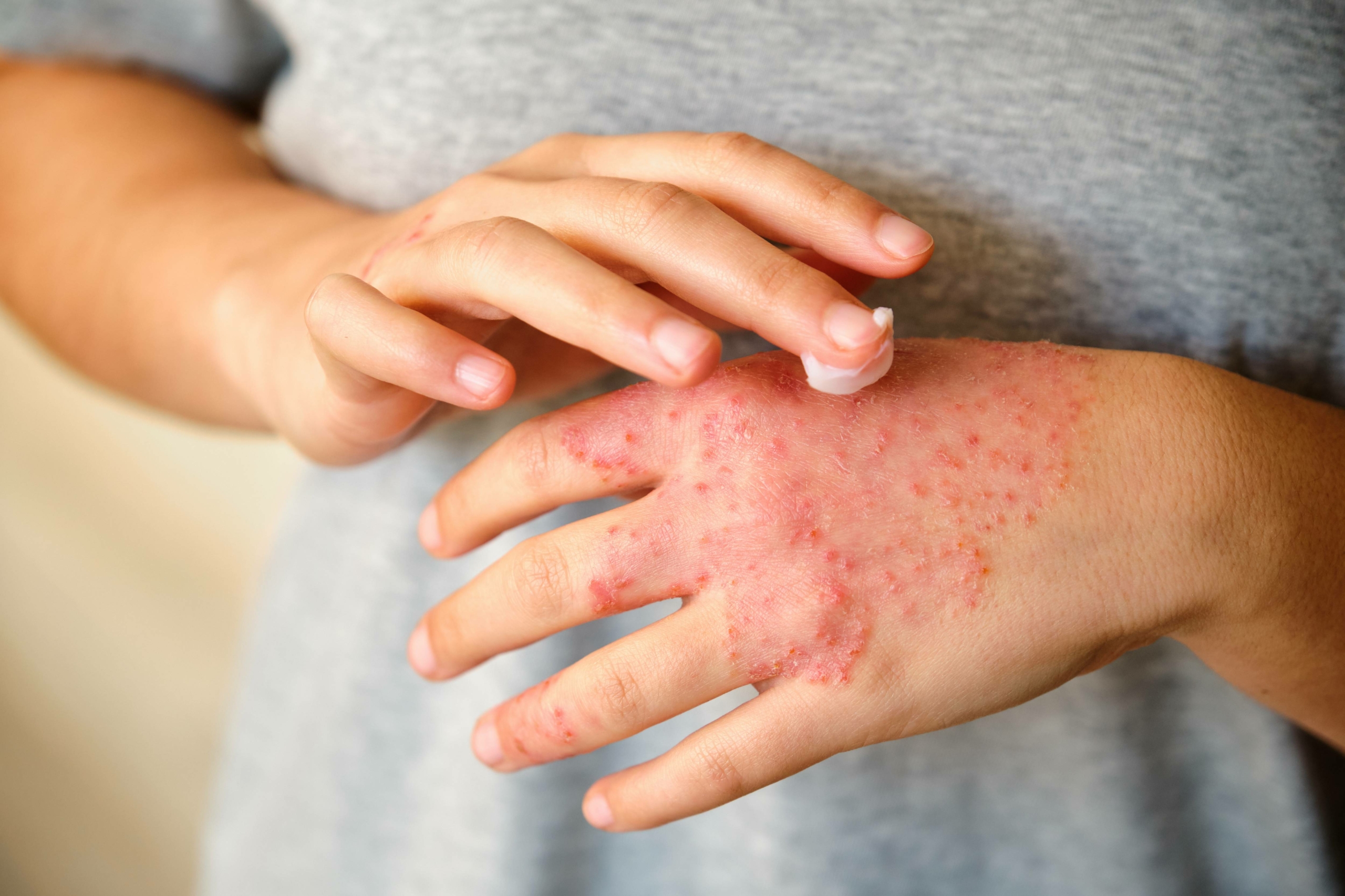
L’ECM est défini comme un processus eczématiforme qui persiste plus de trois mois ou qui récidive au moins deux fois par an. On estime que 2 à 10 % de la population est susceptible de développer un ECM à un moment ou à un autre de sa vie. L’ECM est plus fréquent dans la tranche d’âge 20-30 ans, et les femmes sont deux fois plus touchées que les hommes (1). L’ECM est divisé en 4 sous-types cliniques : hyperkératosique (prédominance masculine, vésicules souvent non visibles, localisation au niveau des paumes, prurit modéré, pas de cause exogène ou endogène retrouvée généralement), vésicules récidivantes (prédominance féminine, évolution cyclique, vésicules sur doigts et paumes, hyperhidrose fréquente), en plaque ou nummulaire (atteinte du dos des mains, contexte fréquent de dermatite atopique, tests épicutanés souvent positifs), pulpaire (pulpite du bout des doigts, prurit modéré, peau rugueuse et douloureuse, causes exogènes fréquentes) (2).
Les étiologies de l’ECM sont multiples et souvent intriquées chez un même patient. Les causes les plus courantes sont la dermatite d’irritation (35 %), l’eczéma atopique des mains (22 %) et la dermatite allergique de contact (19 %) (3). L’ECM représente 9 à 35 % de l’ensemble des maladies professionnelles et jusqu’à 80 % des dermatites de contact professionnelles (fréquent chez les coiffeurs, agriculteurs, ouvriers du bâtiment, personnel médical, métallurgistes) (4).
Traitement
Il est fortement recommandé d’effectuer des tests épicutanés chez tous les patients atteints d’ECM. En cas d’implication d’allergènes ou d’irritants, leur éviction, dans la mesure du possible, peut permettre d’échapper à un traitement au long court.
Le traitement est essentiellement local par dermocorticoïdes puissants associés à des émollients. Les dermocorticoïdes sont efficaces pendant une courte période, mais les effets secondaires de l’atrophie de l’épiderme limitent leur utilisation chronique. L’allergie aux corticostéroïdes n’est pas rare et doit être envisagée lorsque l’ECM ne répond pas au traitement. Le tacrolimus topique est utilisé chez les patients réfractaires aux corticostéroïdes topiques. Une étude intra-participant a montré que le tacrolimus à 0.1% et le furoate de mométasone à 0.1% étaient tous deux aussi efficaces et bien tolérés (5).
La photothérapie locale est une option relativement contraignante pour le patient. Dans une étude publiée en 2015, 23 % des participants traités par UVB-TL01 (n=30) ont vu leur état s’améliorer par rapport à 43 % sous PUVA locale (n=30) après 12 semaines (6).
Chez les patients adultes avec un ECM sévère ne répondant pas au traitement bien conduit par dermocorticoïdes puissants, l’alitrétinoïne est le seul traitement systémique ayant une AMM en seconde intention. D’après une étude randomisée versus placebo chez 1 032 patients atteints d’ECM, en échec ou en réponse transitoire aux dermocorticoïdes, l’alitrétinoïne 10 ou 30 mg a été significativement plus efficace que le placebo sur la proportion de patients répondeurs au traitement (alitrétinoïne 10 mg : 27.5 %, alitrétinoïne 30 mg : 47.7 %, placebo : 16.6 %). Les patients avec une hyperkératose prédominante ont mieux répondu au traitement (7). L’alitrétinoïne n’a pas été comparée à un traitement actif, ni évaluée en association à des traitements locaux.
D’autres traitements systémiques sont utilisés en dehors des indications de l’AMM. Dans un essai croisé sur 34 patients, la ciclosporine 3 mg/kg/j pendant six semaines a été comparée au dipropionate de bétaméthasone 0,05%. L’évaluation globale bonne/très bonne était de 60% dans le groupe ciclosporine et de 31% dans le groupe bétaméthasone (RR 1.88, 95% CI 0.88 à 3.99) (8). Il n’existe pas de preuves claires établissant l’efficacité du méthotrexate dans le traitement de l’ECM, bien qu’un rapport fasse état d’effets positifs chez 37 % des patients dans une étude rétrospective (n=42) (9).
Les deux classes émergentes pour le traitement de l’ECM sont les inhibiteurs de l’IL-4/IL-13 et de JAK. Une étude randomisée chez 30 patients atteints d’ECM atopique a montré que le dupilumab 300 mg tous les 15 jours permettait une très bonne réponse dans 70 % des cas, avec un écart de 37 points par rapport au placebo (10). Des résultats similaires ont été obtenus avec l’upadacitinib 15 et 30 mg dans l’amélioration de l’ECM atopique par rapport au placebo (11). Deux études randomisées ont évalué l’efficacité d’un pan-inhibiteur JAK, le delgocitinib crème 20 mg/g deux fois par jour, chez respectivement 487 et 473 patients en échec des dermocorticoïdes. La présentation de l’ECM était atopique, hyperkératosique, ou en lien avec un eczéma de contact. À la 16e semaine, le succès thérapeutique a été obtenu chez 20 % et 29 % des patients sous delgocitinib, contre 10 % et 7 % sous placebo (p < 0,005) (12).
Afin de guider le dermatologue dans son choix de la meilleure stratégie thérapeutique possible, les futurs essais cliniques devront apporter la confirmation de l’efficacité de ces nouvelles classes thérapeutiques, en tenant compte, si possible, du type clinique d’ECM ainsi que de l’amélioration obtenue par rapport aux traitements actifs existants.
Auteur : Pr Guillaume Chaby, Service de Dermatologie CHU Amiens
Date : 22/11/2024
Références :
- Thyssen JP Johansen JD, Linneberg A, et al. The epidemiology of hand eczema in the general population – prevalence and main findings. Contact Dermatitis 2010; 62: 75-87.
- Diepgen TL, Andersen KE, Brandao FM, et al. Hand eczema classification: A cross-sectional, multicentre study of the aetiology and morphology of hand eczema. Br J Dermatol 2009; 160: 353‐8.
- Meding B, Wrangsjö K, Järvholm B, et al. Survey based assessment of prevalence and severity of chronic hand dermatitis in a managed care organisation. Cutis 2006; 77: 385-92.
- Elston DM, Ahmed DD, Watsky KL, et al. Hand dermatitis. J Am Acad Dermatol 2002; 47: 291‐9.
- Katsarou A, Makris M, Papagiannaki K, et al. Tacrolimus 0.1% vs mometasone furoate topical treatment in allergic contact hand eczema: a prospective randomized clinical study. Eur J Dermatol 2012; 22: 192-6.
- Brass D, Fouweather T, Stocken DD, et al. An observer‐blinded randomized controlled pilot trial comparing localized immersion psoralen–ultraviolet A with localized narrowband ultraviolet B for the treatment of palmar hand eczema. B J Dermatol 2018; 179: 63-71.
- Ruzicka T, Lynde CW, Jemec GBE, et al. Efficacy and safety of oral alitretinoin (9-cis retinoic acid) in patients with severe chronic hand eczema refractory to topical corticosteroids: results of a randomized, double-blind, placebo-controlled, multicentre trial. Br J Dermatol 2008; 158: 808-17.
- Granlund H, Erkko P, Eriksson E, et al. Comparison of cyclosporine and topical betamethasone-17,21-dipropionate in the treatment of severe chronic hand eczema. Acta Dermato Venereologica 1996;76: 371-6.
- Politiek K, van der Schaft J, Christoffers WA, et al. Drug survival of methotrexate treatment in hand eczema patients: results from a retrospective daily practice study. J Eur Acad Dermatol Venereol 2016; 30: 1405-7.
- Voorberg AN, Kamphuis E, Christoffers WA, et al. 2Efficacy and safety of dupilumab in patients with severe chronic hand eczema with inadequate response or intolerance to alitretinoin: a randomized, double-blind, placebo-controlled phase IIb proof-of-concept study. Br J Dermatol 2023; 189: 400-10.
- Simpson EL, Rahawi K, Hu X, et al. Effect of upadacitinib on atopic hand eczema in patients with moderate-to-severe atopic dermatitis: Results from two randomized phase 3 trials. J Eur Acad Dermatol Venereol 2023; 37:1863-70.
- Bissonnette R, Warren RB, Pinter A, et al. Efficacy and safety of delgocitinib cream in adults with moderate to severe chronic hand eczema (DELTA 1 and DELTA 2): results from multicentre, randomised, controlled, double-blind, phase 3 trials. Lancet 2024; 404: 461-73.